Strukturdynamik von Ionenkanälen und -transportern
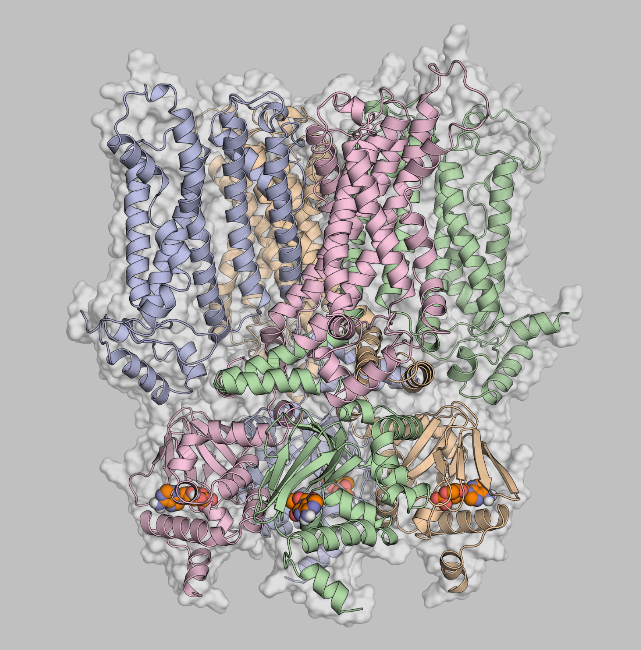
Ionenkanäle und -transporter sind in den Membranen aller lebenden Zellen vorhanden und vermitteln eine Vielzahl von Zellfunktionen. Ionenkanäle ermöglichen die schnelle Veränderung der Membranpermeabilität für Ionen wie Natrium, Kalium und Kalzium. Infolgedessen erzeugen und modulieren sie elektrische Signale in den Zellen. Ionentransporter passen die Ionenkonzentration innerhalb und außerhalb von Zellen an. Als Biomoleküle, die stark an grundlegenden Lebensprozessen beteiligt sind, spielen Ionenkanäle auch eine wichtige Rolle beim Verständnis von Krankheitsmechanismen und therapeutischen Ansätzen.
Kürzlich hat die Deutsche Forschungsgemeinschaft die Förderung der Forschungsgruppe FOR 2518 "Funktionsdynamik von Ionenkanälen und -transportern – DynIon" verlängert, die seit drei Jahren die Funktionsweise dieser Schleusentore durch die Zellmembran untersucht. Der Computerchemiker Prof. Holger Gohlke (Institut für Pharmazeutische und Medizinische Chemie der Heinrich-Heine-Universität Düsseldorf; NIC-Forschungsgruppe "Computational Biophysical Chemistry" am JSC, Forschungszentrum Jülich) und sein Team werden Hyperpolarisations-aktivierte zyklische nukleotidgesteuerte (HCN) Ionenkanäle untersuchen, deren Fehlfunktion zu Krankheiten führen kann. Auf atomistischer Ebene wollen die Wissenschaftler durch molekulare Simulationen und Modellierung verstehen, wie die Kanäle durch Kopplung von Membranpotential und Ligandenbindung aktiviert werden. Molekulardynamik-Simulationen werden in diesem Zusammenhang auf der GPU-Partition von JUWELS durchgeführt. Diese Studien werden durch experimentelle Daten aus dem Labor von Prof. Klaus Benndorf von der Friedrich-Schiller-Universität Jena ergänzt.
Ansprechpartner: Prof. Holger Gohlke,
h.gohlke@fz-juelich.de
aus JSC News No. 274, 30. Juli 2020